Oggi parliamo di un argomento davvero affascinante, stiamo parlando della materia e, in particolare, degli atomi e delle molecole che la compongono, il tutto semplicemente spiegato ai bambini della scuola primaria.
Una molecola è costituita da due o più atomi uniti (o “legati”) strettamente insieme. Il numero e il tipo degli atomi in una molecola, e il modo in cui sono disposti, determinano la sostanza che costituisce.
Ti può anche interessare:
Ad esempio, una molecola composta da due atomi di ossigeno uniti a un atomo di carbonio forma anidride carbonica, un gas incolore. Ma una molecola composta da due atomi di idrogeno uniti a un atomo di ossigeno forma l’acqua, un liquido.
In seguito troverai spiegato per i bambini della scuola primaria tutto quello che può servire a riguardo degli atomi e molecole. Fai riferimento all’indice dei contenuti qui sotto per passare velocemente alla parte desiderata.
Indice
- Prima di tutto: Che cos’è la Materia?
- Da cos’è costituito un’Atomo?
- Cos’è una molecola?
- Chi ha scoperto atomi e molecole?
- La bomba atomica
- Fatti interessanti al riguardo di atomi e molecole
Prima di tutto: Che cos’è la Materia?
La materia è tutto ciò che ha una massa e che occupa uno spazio, tutto ciò che ci circonda, le rocce, l’acqua, l’aria, il suolo, le piante, gli animali, tutti gli oggetti e pur essendo questi oggetti diversi tra loro, hanno tutti una caratteristica in comune, sono fatti di materia.
Anche noi tutti, esseri umani, siamo fatti di materia!
La materia è composta da parti piccolissime che non vediamo a occhio nudo ma solo con l’aiuto di un potente microscopio. Queste particelle piccolissime si chiamano molecole. Ogni molecola, a sua volta, è composta da tante particelle ancora più piccole, chiamate atomi.
Cerchiamo, con questa lettura, di capire più nel dettaglio che cosa sono atomi e molecole, quando e da chi sono stati scoperti e l’importanza di tali scoperte per la scienza e non solo.
Abbiamo già detto che tutti i materiali esistenti sono formati da piccolissime particelle sempre in movimento che possono essere atomi o molecole.
Il movimento degli atomi e delle molecole è tanto più intenso quanto più alta è la temperatura e minore la loro massa. Gli atomi sono le particelle singole più semplici, mentre le molecole sono formate da due o più atomi, uguali o diversi, legati tra di loro.
La parola “atomo” deriva dal greco e significa “indivisibile”, ma vedremo più avanti che invece non è così. L’atomo è costituito dal nucleo. Nel nucleo sono presenti particelle cariche positivamente (i protoni) e prive di carica (i neutroni). Intorno al nucleo ruotano particelle di carica negativa (gli elettroni). Ogni atomo differisce dagli altri per il numero di protoni, neutroni ed elettroni.
Differenze tra atomi e molecole
L’atomo è la più piccola parte di un elemento chimico, sostanza composta da atomi dello stesso tipo, che conserva le caratteristiche chimiche dell’elemento stesso. Tutti gli elementi chimici sono formati da singoli atomi, tranne poche eccezioni che sono formati da molecole.
Raggruppamenti di atomi legati tra loro danno vita a una molecola. Le molecole possono essere formate da atomi dello stesso tipo, molecole di elementi, o da atomi di tipo diverso, molecole di composti.
Da cos’è costituito un’Atomo?
L’atomo è composto da più elementi legati insieme:

- I neutroni e i protoni
I protoni e i neutroni formano insieme il cuore dell’atomo, il nucleo. Queste particelle hanno più o meno la stessa massa, cioè sono formate da una quantità di materia quasi uguale, ma mentre il protone ha una proprietà chiamata carica elettrica positiva, il neutrone non la possiede.
- Gli elettroni.
Intorno al nucleo si muovono velocissimamente gli elettroni. Gli elettroni sono piccolissimi, hanno un massa così piccola che ne servono 1836 per uguagliare la massa di un protone. Anche gli elettroni hanno una carica elettrica, ma è diversa da quella del protone, è infatti una carica negativa.
- La molecola.
Il termine molecola, deriva dalla parola “moles”, che significa mole, piccola quantità e che indica quindi un’unità di misura della materia. Gli atomi hanno la capacità di unirsi tra loro formando le molecole. Per molecola si intende quindi un insieme di atomi uniti da un legame chimico. Una molecola può essere caratterizzata da più atomi di un solo elemento chimico o da atomi di elementi diversi. Esistono le molecole semplici e le molecole complesse.
- Orbita
L’orbita è la traiettoria descritta da un corpo in movimento nello spazio nel suo moto attorno a un punto
Cos’è una molecola?
Alcune molecole costituiscono gli elementi chimici. Gli elementi chimici sono le sostanze di cui è composta tutta la materia.
Cioè, ogni cosa nel mondo è o un elemento puro o una combinazione di due o più elementi. Le molecole degli elementi puri contengono un solo tipo di atomo.
Ad esempio, le molecole dell’elemento ferro sono costituite solo da atomi di ferro.

Alcuni elementi hanno molecole composte da un singolo atomo. Ad esempio, una molecola di gas di elio è costituita da un atomo di elio.
Ma la maggior parte degli elementi ha molecole che contengono almeno due atomi uniti insieme. Ad esempio, una molecola di ossigeno gassoso è composta da due atomi di ossigeno.
I simboli e le formule
I simboli sono un modo per rappresentare un atomo, una specie di “codice fiscale dell’atomo”.
Per esempio H indica l’ IDROGENO, mentre la O rappresenta l’ OSSIGENO
Una molecola di acqua è costituita da due atomi di idrogeno, (H) e da un atomo di ossigeno (O). Usando questi simboli, una molecola d’acqua è rappresentata con la formula H2O, dove il numero due indica che nella molecola d’acqua vi sono due atomi di idrogeno.
Un’altro esempio è O2 che è la formula dell’ossigeno e indica che in una molecola sono presenti 2 atomi di ossigeno (simbolo O)
C12H22O11 È la formula di un tipo di zucchero e indica che in una molecola sono presenti 12 atomi di carbonio (simbolo C), 22 atomi di idrogeno (simbolo H) e 11 atomi di ossigeno (simbolo O) … ma forse meglio continuare a chiamarlo semplicemente zucchero!
Gli elementi chimici
Carbonio, rame, ferro, oro, argento, sodio, cloro etc sono elementi chimici, ovvero un atomo caratterizzato da un determinato numero di protoni. Ognuno di questi elementi, per brevità, è indicato con un simbolo che deriva dal nome dell’atomo.
Ogni simbolo è formato dalla prima, o dalle prime due, lettere del nome dell’atomo, per non creare confusione tra atomi i cui nomi hanno la stessa iniziale. Per esempio, C è il simbolo del carbonio, Ca quello del calcio.
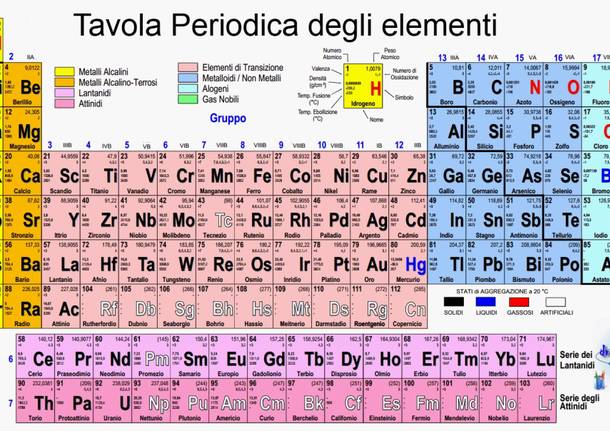
Che cosa è la Tavola degli Elementi?
La tavola periodica degli elementi, è lo schema col quale vengono ordinati gli atomi sulla base del loro numero atomico. Ideata dal russo Mendeleev nel 1869. Inizialmente contava molti spazi vuoti previsti per elementi che sarebbero stati scoperti solo in futuro. Ad oggi abbiamo 118 elementi chimici.
Chi ha scoperto atomi e molecole?
Cominciamo subito col dire che la storia della scoperta dell’atomo non si è ancora conclusa, tutt’altro è in continuo sviluppo.
Ripercorriamo ora la storia a grandi linee di queste scoperte importantissime ed affascinanti.
Intorno al 500 a.C. due filosofi, Leucippo e Democrito, si domandarono quante volte la materia si sarebbe potuta dividere a metà. Immaginate di tagliare una mela a metà, e poi ancora, e ancora e ancora, fino a quando raggiungete un punto non più divisibile. Ovviamente parliamo di dividerla fino al punto in cui le parti non sono più visibili semplicemente con l’occhio umano, ma bisogna usare strumenti come microscopi estremamente potenti. Quando arrivarono a questo punto, chiamarono questa particella elementare che avrebbe formato tutta la materia atomo, che in greco significa ‘indivisibile’.
Per più di 2000 anni, nessuno indagò più sulla struttura della materia e l’idea di atomo venne abbandonata.
Gli studi sull’atomo vennero ripresi nel 1800 da un chimico inglese di nome John Dalton. Quest’ultimo, basandosi sulle sue ricerche e sulle conclusioni di altri suoi due colleghi, Lavoisier e Proust, elaborò una teoria scientifica che dimostrava come la materia dovesse essere formata da particelle elementari che si combinavano e si dividevano per formare ogni sostanza dell’universo.
In omaggio ai due filosofi greci, Dalton chiamò questa particella atomo.
Nel 1897, anche il fisico inglese J.J. Thomson condusse un esperimento sulle proprietà elettriche della materia. lo scienziato scoprì che la materia era formata da particelle cariche negativamente.
Thomson chiamò queste particelle: elettroni. Concluse che, se esistevano particelle negative, allora dovevano esistere anche particelle positive.
Thompson, quindi, descrisse il primo modello atomico, ovvero la rappresentazione fisica dell’atomo, come “modello a panettone” perché l’atomo era visto come una nube di carica positiva e gli elettroni erano disposti al suo interno, in modo quasi casuale come i canditi e l’uvetta nel panettone!!!
Fu a questo punto che la teoria della indivisibilità dell’atomo venne messa in discussione. La scoperta dell’elettrone dimostrò che l’atomo era in realtà divisibile. Infatti esso è a sua volta composto da particelle più piccole, chiamate particelle subatomiche.
Gli studi di Thompson furono il punto di partenza anche di Ernest Rutherford nel 1911 che indagò più a fondo la struttura atomica e concluse che la teoria del suo predecessore presentava degli errori.
Tanti sono stati i fisici che hanno studiato l’atomo, apportando teorie più o meno valide, fino a quando nel 1932 il fisico inglese James Chadwick fece una scoperta importantissima ed innovativa.
Osservò che mancava ancora qualcosa. La massa mancante del nucleo dipendeva dall’esistenza di una terza particella sub-atomica: il neutrone.
Con questa scoperta si fa luce anche sulla differenza tra le masse degli stessi elementi: si scoprono gli isotopi, un tipo diverso di atomo. Per questa scoperta Chadwick riceverà il premio Nobel nel 1935.
Le scoperte di Chadwick cambiarono drasticamente l’immagine dell’atomo e accelerarono le scoperte della fisica atomica.
La bomba atomica
Tra il 1941 ed il 1945, un gruppo di scienziati americani sviluppano la bomba atomica. La bomba atomica sfrutta un fenomeno fisico chiamato della fissione nucleare: il nucleo di certi atomi pesanti, autonomamente o perché bombardato da un neutrone, si spacca in due.
La prima bomba atomica viene fatta esplodere il 16 luglio 1945 nel deserto del Nuovo Messico, ad Alamogrado. Verso la fine della seconda guerra mondiale, il 6 Agosto del 1945 viene lanciata la bomba atomica sulla città giapponese di Hiroshima e in pochi secondi la città fu distrutta.
Tre giorni dopo, il 9 agosto, gli Stati Uniti lanciarono un’altra bomba atomica , questa volta sulla città di Nagasaki.
Oltre alla morte immediata di migliaia e migliaia di persone, le bombe atomiche lanciate su Hiroshima e Nagasaki portarono ad una serie di conseguenze terribili che, per lungo tempo, segnarono tutta l’area a causa delle radiazioni e delle bruciature o a causa del cancro o di malformazioni alla nascita dovute proprio alle radiazioni rilasciate dalla bomba atomica. Queste radiazioni rimasero presenti sul territorio per molti anni.
Fatti interessanti al riguardo di atomi e molecole
Di che colore è l’ossigeno?
Ai nostri occhi, e allo stato aeriforme, come sappiamo l’ossigeno molecolare dell’aria appare trasparente. Ma forse non tutti sanno che, sia in forma liquida sia in forma solida, l’ossigeno è invece di colore blu. Riprodurre l’esperimento a casa però non è affatto semplice, perché bisognerebbe raffreddarlo fino a -218°C!
I sensi molecolari
Anche noi, nel nostro piccolo, ci possiamo rendere conto che esistono moltissimi tipi di molecole diverse, grazie ai nostri sensi, dato che riconosciamo moltissimi sapori e odori diversi. Le molecole comunicano con i nostri sensi.
Vista e udito sono sensi che rispondono a stimoli fisici, vediamo una luce o sentiamo un rumore anche se non veniamo a contatto con questi fenomeni.
Gusto e olfatto invece richiedono un contatto diretto con le molecole che suscitano in noi le sensazioni di dolce o di amaro, di puzza o di profumo.

